胃がんの発生・進行について
胃がんは胃の粘膜から発生し、年月をかけて診断可能な大きさになるといわれています。
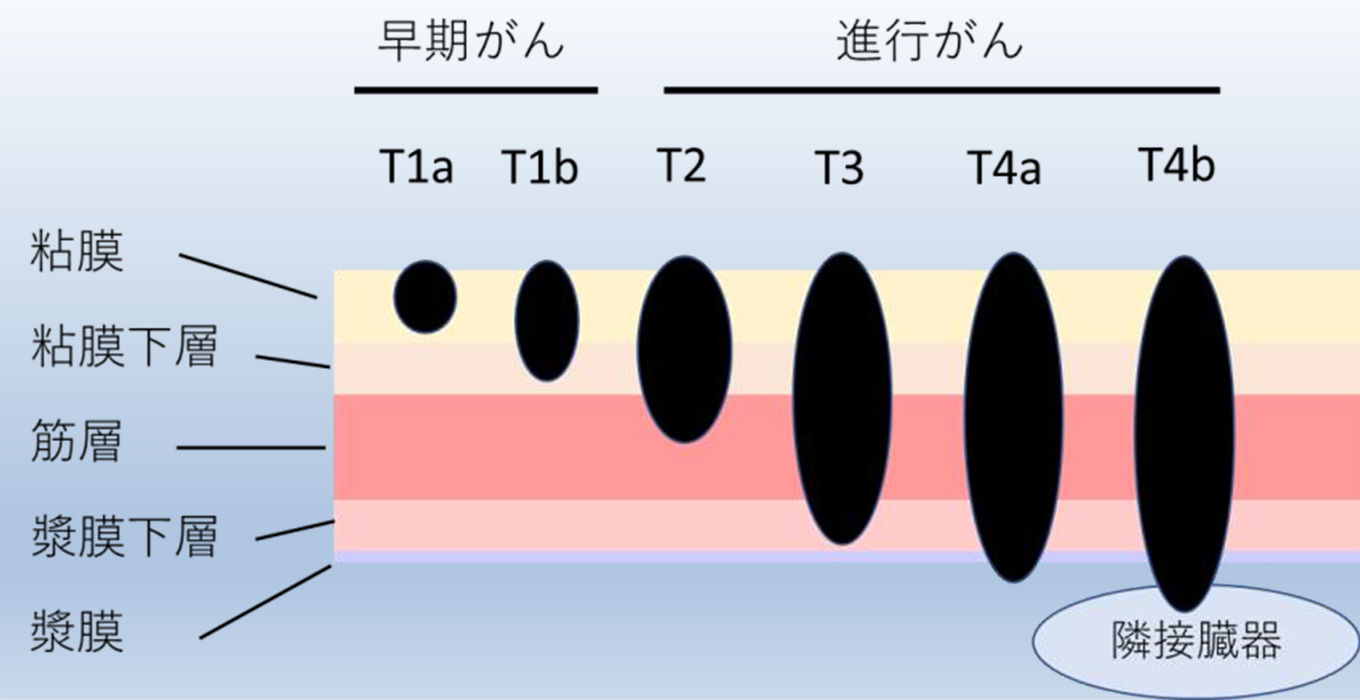
胃の壁は、粘膜・粘膜下層・筋層・漿膜にわかれています。胃壁におけるがんの浸潤の程度を深達度と呼びます。粘膜下層までの浸潤でとどまっているものを早期胃がんとし、筋層まで浸潤しているものを、進行がんとしています。早期がんであっても、粘膜下層まで浸潤すると血管やリンパ管から転移していく可能性があります。また漿膜を超えて浸潤した場合、がん細胞が腹腔内(お腹の中)にこぼれて、がんが拡がり(腹膜播種)、腹水の出現や腸閉塞を来す可能性があります。
進行度(病期)について
深達度・リンパ節転移・遠隔転移(他臓器への転移)で病期を決定します。
病期はStageとも呼び、手術前の画像で判断した病期、手術所見で判断した病期、そして摘出した胃とリンパ節を病理組織学的(顕微鏡にて)に最終的に判断した病期を決定します。
深達度
T1a:粘膜 T1b:粘膜下層
T2:筋層 T3:漿膜下 T4a:漿膜露出 T4b:他臓器浸潤
リンパ節転移
転移には、がん細胞が血液の流れにのって転移する血行性転移(肝転移や肺転移など)とリンパの流れに乗って転移するリンパ行性転移があります。
- N0:リンパ節転移を認めない
- N1:1~2個のリンパ節を認める
- N2:3~6個のリンパ節を認める
- N3:7個以上のリンパ節を認める
遠隔転移
- M0:領域リンパ節以外の転移を認めない
- M1:領域リンパ節以外の転移を認める
病期(Stage)
転移リンパ節の個数

胃がんの治療について
胃がんの治療は、病期によって異なります。胃癌治療ガイドラインによる日常診療で推奨される治療選択アルゴリズム(2014年日本胃癌学会編:胃癌治療ガイドライン第4版)に基づき、さらに治療を発展させていくことを念頭に診療にあたっています。
手術‐腹腔鏡手術‐
私たちは、最先端の低侵襲胃がん治療を
提供します。
私たちは、腹腔鏡手術がもつ、傷が小さく整容的に優れている点、手術侵襲による負担が少なく術後の回復が早い点、拡大視効果(細かい解剖まで詳細に識別できる)から、より繊細で緻密な手術を提供できる腹腔鏡手術を重視しています。
腫瘍の位置、術式に問わず、早期胃がんのみならず進行胃がん、重複がん(2つ以上のがんの存在)、過去に開腹手術を受けたことのある症例,胃全摘が必要な症例、噴門側胃切除症例などにおいても精度の高い腹腔鏡手術を提供します。
現在、胃癌治療ガイドライン上、胃がんに対する腹腔鏡下手術が推奨されているのは、標準治療である開腹手術と安全性が同程度であると確かめられているStageⅠの比較的初期の胃がんに対する幽門側胃切除術とされています。胃がんに対する腹腔鏡手術は、進行胃がんも含め、保険収載されてから15年以上経過していますが、現在、各施設間において進行胃がんに対する腹腔鏡手術の適応に違いがあります。重複がん(2つ以上のがんの存在)やこれまでに開腹手術を受けたことのある症例、胃全摘の症例、噴門側胃切除症例などにおいてもその適応は施設により異なっています。その理由として、腹腔鏡手術を遂行する上での技術格差が施設間で大きく異なることが挙げられます。当施設では,この手術に精通・熟練した専門医師が在籍しており安全で確実な手術を提供できるものと考えています。
進行胃がんに対し、これまでに経験した症例の検討では、腹腔鏡手術と開腹手術の間に予後の差はみられませんでした。ただし、日本で行われた進行胃がんに対する腹腔鏡手術と開腹手術と比較した、大規模な臨床試験の長期成績の結果が出るのは、2020年頃とされており、それまでは腹腔鏡手術の本当の優位性は言えない状況にはあります。
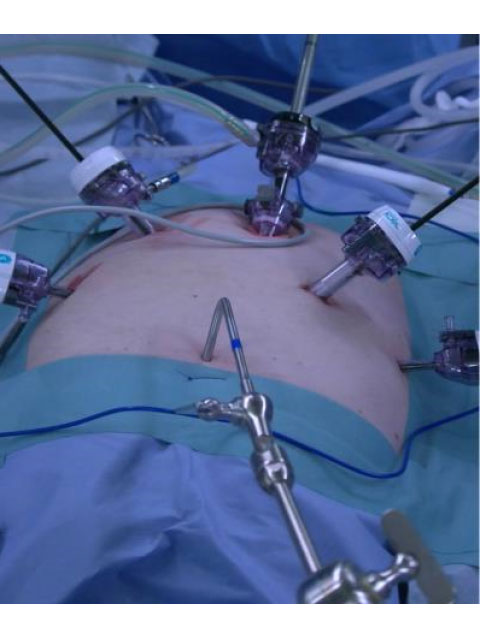
腹腔鏡手術は、腹部に小さい穴を数カ所開けて、腹腔鏡専用の器具と腹腔鏡(カメラ)を用いて手術を行います。開腹手術と同様に全身麻酔で手術を行います。腹腔鏡手術は、炭酸ガスにて腹腔内を膨らませ、腹部に小さい穴を数カ所開けて、腹腔鏡専用の器具と腹腔鏡(カメラ)を用いて腹腔鏡で映し出したモニターを見て手術を行います。
手術は、①摘出 ②リンパ節郭清 ③再建を行います。
- 摘出:胃の切除範囲は、がんの位置とその進行度によって決めます。基本的には、がんの位置が幽門部に近い場合は幽門側胃切除を、噴門に近い場合は胃全摘術を選択します。早期胃がんの場合で噴門の近くにのみある場合は、噴門側胃切除を行うことがあります。
- リンパ節郭清:胃の領域(胃に関わる)のリンパ節を摘出します。術後病理組織学検査にてリンパ節転移の有無を調べ、術後に追加の治療が必要かどうかの判断をします。
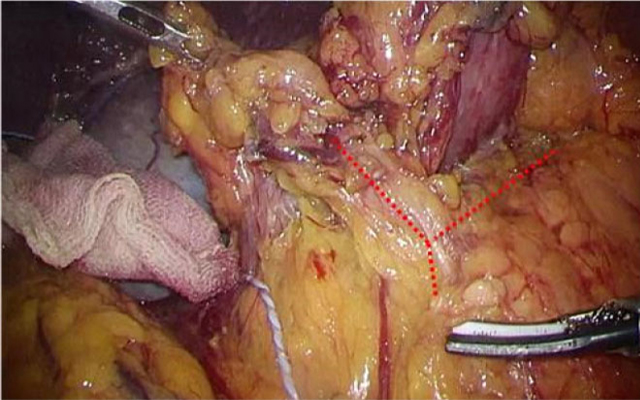
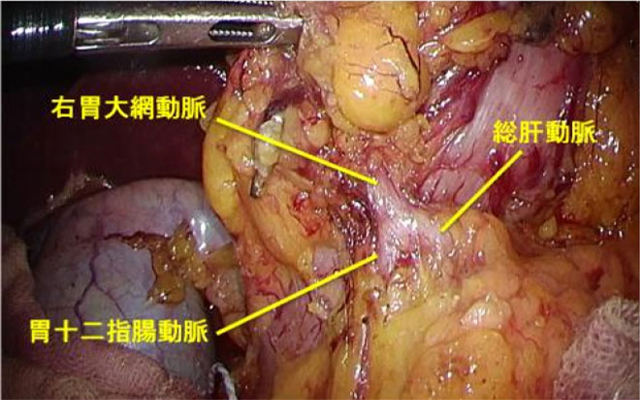
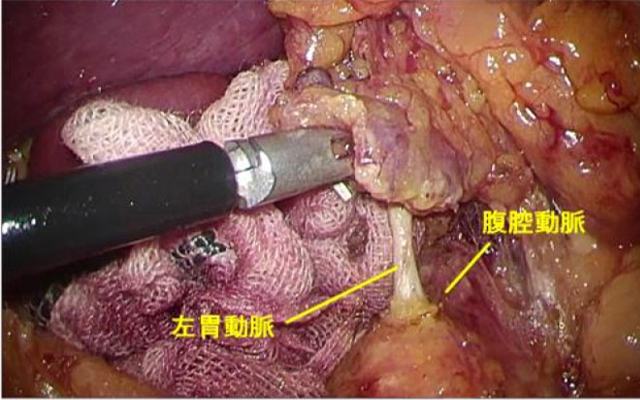
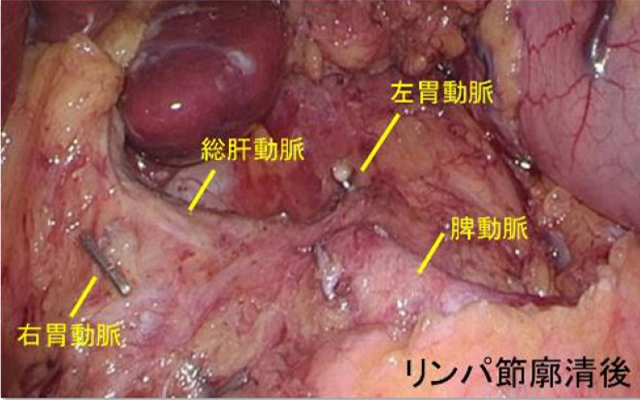
- 再建:胃を切除した後の、食事の通り道を作ります。再建方法は、切除範囲によって異なってきますが、このような再建方法があります。
BillrothⅠ法 残胃(残った胃)と十二指腸を吻合します。 BillrothⅡ法 残胃と小腸を吻合します。十二指腸に流入する胆汁・膵液の通り道として小腸‐小腸吻合を追加することがあります。 Roux-en-Y法 残胃‐小腸 or 食道‐小腸と小腸‐小腸吻合を施行します。 Double tract法 食道と小腸・小腸と残胃・小腸と小腸を吻合します。 食道残胃吻合法 食道と残胃を吻合します。切除後の状況を考慮した上で、最適と考えられる方法で吻合してきます。
<再建例> BillrothⅠ法再建(幽門側胃切除術)
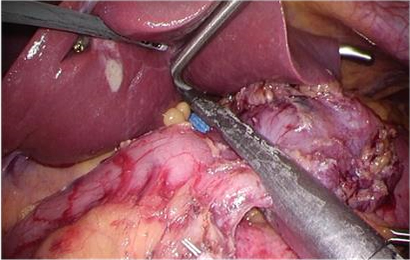
十二指腸を切断
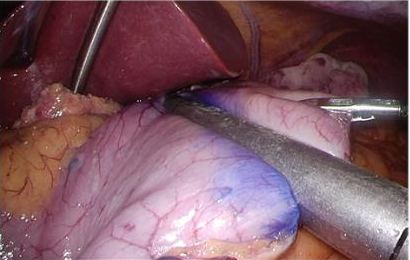
胃を切断
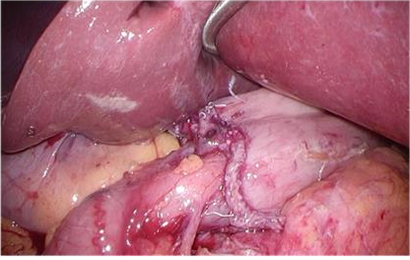
十二指腸と胃を吻合
リンパ節を郭清する目的、他臓器浸潤を認めた際に他臓器の合併切除や、胃がん術後の胆嚢炎を予防する目的で胆嚢を合併切除する可能性があります。
また術中、術前画像診断の状況と異なり進行度が予想以上に進んでいた場合、症状緩和目的に胃‐小腸バイパス術やがんの減量目的とした手術を行う場合や、試験開腹(お腹の中の観察のみで手術を終える)となる可能性があります。手術中の判断にて術式の変更を余儀なくされる場合があります。
手術‐合併症について‐
手術は体に侵襲を加えて治す治療法です。そこに伴う合併症が発症する可能性があります。
また胃を切除することに伴う後遺症が発症する可能性があります。高齢、糖尿病、呼吸器障害、肥満、循環器疾患などをお持ちの方は合併症を起こしやすい状況にあります。
また胃を切除することに伴う後遺症が発症する可能性があります。胃を切除した後には、食べ物の貯蔵と先の腸管へ送り込む蠕動運動の働きが悪くなるため、食生活に影響が出る可能性があります。食事量の減少や、早期ダンピング症候群(いきなり食べ物が腸へ流れこんでしまうため、腸液が多量に分泌され、動悸、発汗、めまい、眠気、腹鳴、脱力感、顔面紅潮、蒼白、下痢などを引き起こすこと)、晩期ダンピング症候群(胃内容物の急速な排出によって急激に血糖値が上昇し、それに反応して血糖値を下げるホルモンであるインスリンが大量に分泌され、逆に血糖値が下がり過ぎるため、食後2~3時間して、脱力感、冷や汗、倦怠感、めまい、意識消失などを引き起こすこと)があります。多くは、1回の食事量を減らし、回数を増やすことや、食事にかける時間を長くするなどの食事の摂り方の工夫で改善することができます。
化学療法(抗がん剤)について
術後補助化学療法
手術で確実に切除できた後に、細胞レベルで残存するかもしれない微小腫瘍に対し、再発予防を目的として行う化学療法です。術後の病理組織学検査の結果に応じて、全身状態、併存疾患に応じて施行する化学療法を決定します。ガイドラインでは、病期Ⅱ/Ⅲ(ただしT3N0とT1を除く)の症例を対象としています。
術前化学療法
手術前に、再発の要因となる微小転移をあらかじめ消滅させることを目的として行う化学療法です。術前化学療法施行後に手術を行います。術前化学療法によって腫瘍を縮小させ確実に切除できる可能性を高めることや、他臓器の合併切除を避けることを目的とします。実施する症例は、手術による治癒切除を達成することができるが、再発の危険性が比較的高い症例や、治癒切除が可能でも予後が不良な症例:例えば高度なリンパ節転移を有する、または大型胃がんなどの高度進行がんが挙げられます。ただし、効果がない場合、がんが進行してしまう危険性もあります。
治療目的の抗がん剤
治療前から遠隔リンパ節転移、腹膜播種や肝転移などの遠隔転移がある StageⅣにある場合や、手術で完全に切除できなかった場合、手術後に再発をきたした場合に治療目的に抗がん剤を含めた集学的治療を考慮します。手術前の場合、抗がん剤治療を施行した結果、腫瘍を縮小させた結果、切除可能と判断した場合、手術を行える可能性もあります。





